世间万物皆有规律,哪怕是小到一个细胞,也有规律可循。
一个细胞变为两个细胞,两个细胞变为4个细胞……人体内所有细胞都是经过这样的分裂过程产生的。在正常情况下,人体能够精准控制体内的细胞分裂过程——哪些细胞应该分裂,分裂什么时候开始,什么时候结束,分裂进行几次,这些都需要遵循严格的秩序。
然而,当癌症发生时,少数细胞摆脱了这些规则的约束,开始无休止地分裂,最终在本不该发生细胞增殖的部位,产生大量细胞聚集,即表现为肿瘤。细胞分裂失控,是肿瘤不断增殖的重要原因,因此减缓甚至抑制细胞分裂,被认为是肿瘤治疗的最有效策略之一。
前不久,中国科学院深圳先进院的研究团队发现,一种名为黑磷纳米的材料,可以影响细胞分裂的进行,进而为肿瘤纳米药物的研发,提供了新思路。
8月5日,中国科学院深圳先进院李红昌团队、喻学锋团队和李洋团队等合作完成的这项研究成果,发表于国际学术期刊《自然—纳米技术》。李红昌课题组副研究员邵喜明和研究助理丁智昊为论文并列第一作者,李红昌、喻学锋和李洋副3位研究员为论文共同通讯作者,中国科学院深圳先进技术研究院为第一作者单位和通讯作者单位。
李红昌说,在过去几十年,基于纳米技术的药物研发已经被广泛开展。在抗肿瘤领域,纳米药物可以提供更好的靶向性和优异的药学性质,因此被寄予厚望。但是,目前已有的纳米药物,大都属于纳米载体药物,这种药物只是对传统药物的改良,纳米材料在其中仅仅充当了药物载体的功能。
“如果把纳米药物整体比作一个胶囊,纳米材料其实只发挥了‘壳’的作用。纳米材料能否上升到‘核心药物’的地位,关键在于能否发现具备详细生物机制和明确成药机理的纳米材料。”李红昌说。
在此次研究中,研究团队选取黑磷纳米材料为研究对象,通过精细的细胞生物学和分子生物学研究,发现纳米材料在细胞内能够精准靶向特定生物分子,并获得独特的生物效应,借此提出了以分子细胞生物学机制为依托的纳米精准分子靶向药物概念,为纳米药物研发开辟新路径。
邵喜明介绍,作为一种由单一磷元素构成的新型纳米材料,黑磷具有独特的分子结构和界面特性,在多个领域具有应用潜力。此前,研究团队已经发现黑磷具有较高的生物活性和生物可降解特性,在肿瘤治疗等生物医学领域具备良好的应用潜能。
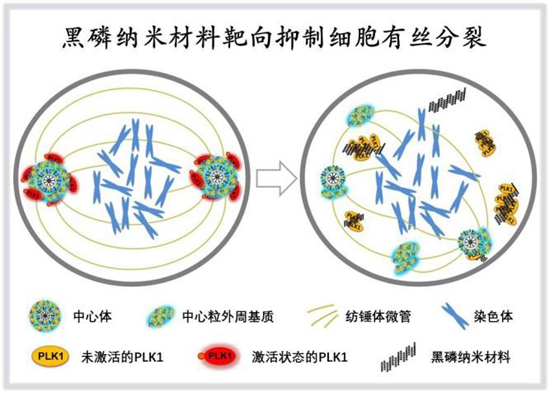
然而,黑磷作为一种无机纳米材料,能否在分子细胞层面与生命系统产生相互作用尚不得知。在此次研究中,研究团队发现,黑磷纳米材料就像“纳米导弹”一样,可以影响细胞分裂的进行,并以此为机制抑制肿瘤细胞增殖。
基于这项发现,团队提出了肿瘤精准靶向“纳米磷疗”的新概念,为未来基于黑磷开发新型肿瘤治疗药物,奠定了科学基础。
邵喜明说,研究团队首先使用低浓度黑磷纳米材料处理细胞,发现黑磷导致细胞周期停滞在有丝分裂期。随后,团队对这一现象背后的机理进行了深入挖掘,发现黑磷破坏了细胞有丝分裂核心机器——纺锤体的组装。这一机制被最终确定为黑磷导致细胞分裂停滞的直接原因。
“同生物体内其他生命过程一样,细胞分裂需要众多生物分子的参与,其中PLK1激酶是非常关键的分子开关,其主要功能是控制纺锤体的组装和运行。”李红昌说。
据他介绍,黑磷进入细胞后,通过伪装成PLK1的作用底物,吸引了大量PLK1蛋白与之结合,并使这些PLK1活性丧失,进一步造成纺锤体错误组装,最终阻断了细胞分裂的正常进行。
邵喜明说,基于这一机制,黑磷纳米材料被赋予了基本的抗肿瘤药物性质。在随后的动物实验中,研究团队利用小鼠荷瘤模型,进一步证实了黑磷具备抗肿瘤效果。
磷是自然界中普遍存在的一种非金属元素,也是地球上所有生命形式的重要组成成分。研究磷和生命系统之间的相互作用对理解生命规律以及生命进化都有重要意义,但是相关研究工作的开展需要横跨“材料学”和“生物学”两个一级学科,因此对研究团队的学科背景提出了很高要求。
在此次研究过程中,研究团队发挥了学科交叉的特色,自发组成了一支材料学与生物学交叉研究队伍,成功让“材料”与“生物”发生深度融合。
比如,研究团队中的喻学锋课题组,对黑磷纳米材料进行了6年的系统研究,已经建立了完整的黑磷基纳米材料的制备和应用体系,在研究过程中主要负责纳米黑磷的制备和性能研究;李红昌课题组,则精通细胞分裂机制和抗肿瘤药物研发,在研究中主导纳米黑磷的生物机制研究;李洋课题组具有丰富的纳米生物学研究经验,在研究过程中,提供符合研究方向和适用于交叉研究团队的新思路,起着“思路润滑”的作用。
“在实际研究过程中,单个课题组很难做到‘既懂材料,又通生物’,因此对类似横跨多个学科的课题,往往难以持续深入地进行,大多研究只能是‘浅尝辄止’。”李红昌说。
他告诉记者,通过“材料人”和“生物人”之间不停地“思想碰撞”和持续地“互通有无”,项目组最终发现了无机单质纳米磷材料影响细胞分裂的重要现象,并深入解析了背后的分子细胞机制,这也是中科院深圳先进院坚持“学科交叉”理念和秉承“面向世界科技前沿”导向而产生的又一个代表性科研成果。
中青报·中青网记者 邱晨辉


 上一版
上一版






 缩小
缩小 全文复制
全文复制 上一篇
上一篇



